[e-sbmptn.com] Pada kesempatan kali ini kita akan membahas materi teori asam basa. Selain teori asam basa kita juga akan membahas beberapa contoh soal teori asam dan basa beserta pembahasan. Asam dan basa memiliki keterkaitan yang erat dengan kehidupan manusia, didalam tubuh manusia terdapat keseimbangan asam dan basa untuk beradaptasi dan tetap menjaga fungsinya dengan baik. Sebagai contoh, seperti asam lambung yang dapat membunuh mikroorganisme yang terdapat pada makanan yang kita konsumsi. Teori yang paling sederhana tentang asam basa pertama kali dikemukakan oleh
Svante Arrhenius pada tahun 1884. Menurut teori Arrhenius, asam adalah
spesies yang mengandung ion-ion hidrogen, H+ atau H3O+, dan basa mengandung ion hidroksida (OH–).
Teori Singkat Asam dan Basa
Dari keseluruhan teori asam basa, maka dapat disimpulkan sebagai berikut.Teori Asam Basa Arrhenius
Teori asam basa Arrhenius didasarkan pada pembentukan ion dan pada larutan berair (aqueous solution).- Asam adalah spesies yang menghasilkan ion H+ atau H3O+ dalam larutan berair.
- Basa adalah spesies yang menghasilkan ion OH– dalam larutan berair.
Teori Asam Basa Lewis
Teori asam basa Lewis didasarkan pada transfer pasangan elektron.- Asam adalah spesies penerima (akseptor) pasangan elektron.
- Basa adalah spesies pemberi (donor) pasangan elektron.
Teori Asam Basa Brønsted-Lowry
Teori asam basa Brønsted-Lowry didasarkan pada transfer proton.- Asam adalah spesies pemberi (donor) proton.
- Basa adalah spesies penerima (akseptor) proton.
Sifat Asam dan Basa
Sifat Asam- Mempunyai rasa asam (jangan coba untuk dicicipi). Kata asam berasal dari bahasa Latin acere yang berarti asam.
- Mengubah lakmus dari warna biru ke merah.
- Larutan asam menghantarkan arus listrik (bersifat elektrolit).
- Bereaksi dengan basa membentuk garam dan air.
- Menghasilkan gas hidrogen ketika bereaksi dengan logam (seperti logam alkali, alkali tanah, seng, aluminium).
Sifat Basa
- Mempunyai rasa pahit (awas jangan sekali-sekali mencicipinya!).
- Terasa licin atau bersabun (awas jangan secara langsung menyentuhnya!).
- Mengubah lakmus dari warna merah ke biru.
- Larutan basa menghantarkan arus listrik (bersifat elektrolit).
- Bereaksi dengan asam membentuk garam dan air.
Contoh Asam dan Basa
Contoh asam dalam kehidupan sehari-hari:- Buah, misalnya jeruk, nanas, dll
- Vitamin C (asam askorbat)
- Asam cuka (mengandung sekitar 5% asam asetat)
- Asam karbonat (terdapat pada minuman ringan)
- Sabun Mandi
- Bubuk Deterjen
- Pemutih
- Pembersih lantai
- Obat nyeri lambung (promag, dll)
Kekuatan Asam Basa
Suatu asam atau basa disebut kuat jika terurai sempurna (atau mendekati sempurna) di dalam air, kekuatan ini disebut juga dengan kekuatan ionisasi.
Contoh asam kuat adalah: HCl, HBr, H2SO4, HNO3, HI, HIO4, dan HbrO4. Untuk basa kuat contohnya adalah: NAOH (natrium hidroksida), KOH (kalium hidroksida), Ba(OH)2 dan juga yang berasal dari golongan alkali (golongan IA) seperti Na dan K, dan logam alkali tanah (golongan IIA) seperti Mg, dan Ca.
Asam dan basa yang lemah adalah asam basa yang tidak akan terurai atau terionisasi secara sempurna ketika dilarutkan kedalam air. Contohnya asam lemah adalah seperti HA. Sedangkan contoh basa lemah adalah NH4OH (ammonium hidroksida)
Contoh asam kuat adalah: HCl, HBr, H2SO4, HNO3, HI, HIO4, dan HbrO4. Untuk basa kuat contohnya adalah: NAOH (natrium hidroksida), KOH (kalium hidroksida), Ba(OH)2 dan juga yang berasal dari golongan alkali (golongan IA) seperti Na dan K, dan logam alkali tanah (golongan IIA) seperti Mg, dan Ca.
Asam dan basa yang lemah adalah asam basa yang tidak akan terurai atau terionisasi secara sempurna ketika dilarutkan kedalam air. Contohnya asam lemah adalah seperti HA. Sedangkan contoh basa lemah adalah NH4OH (ammonium hidroksida)
Contoh Soal Asam Basa dan Pembahasan
Soal Asam Basa No.1
Sebutkan lima contoh bahan disekitar Anda yang dapat digunakan untuk indikator asam basa!
Pembahasan:
1. Daun pandan
2. Bunga kertas
3. Kembang sepatu
4. Kol ungu
5. Kunyit
Soal Asam Basa No.2
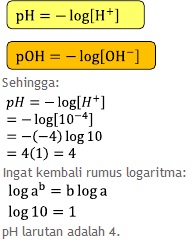
Tentukan pH dari suatu larutan yang memiliki konsentrasi ion H+ sebesar 10− 4 M.
Pembahasan:
Menghitung pH larutan atau pOH larutan.
Dik:
[H+] = 10−4, dengan rumus yang pertama untuk mencari pH
Dik:
[H+] = 10−4, dengan rumus yang pertama untuk mencari pH
Soal Asam Basa No.3
Lengkapi persamaan reaksi ionisasi asam/ basa berikut:
a. CH3COOH(aq) →
b. H2CO3(aq) →
c. HNO3(aq) →
d. NH4OH(aq) →
e. Ca(OH)2 →
Pembahasan:
Soal Asam Basa No.4
Tentukan spesi yang bertindak sebagai asam dan basa dan pasangan asam basa konjugasi di bawah ini:
Pembahasan:
Soal Asam Basa No.5
pH 0,100 M larutan asam format pada 25 derajat Celcius adalah 2,38. Hitunglah Ka nya !
Pembahasan:
Untuk mendapatkan contoh soal lainnya, silahkan klik disini
![SOAL UTBK SAINTEK SOSHUM TPS DAN PEMBAHASAN [PDF]](https://3.bp.blogspot.com/--qubWEFrlCU/WpBkTmKCS7I/AAAAAAAAG_s/iR__LHgMVz0FiD8xRv4z7ljKwomvuX3UgCK4BGAYYCw/s600/esb3.jpg)










No comments:
Post a Comment